狗万醫藥創新型肉毒素產品RT002治療適應症上市申請獲受理

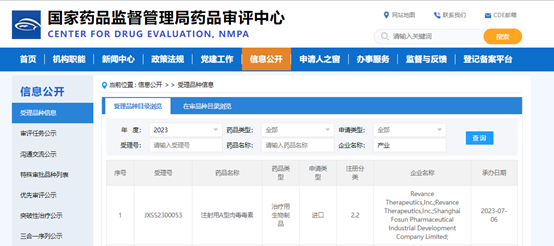
狗万醫藥產(chan) 業(ye) 於(yu) 2018年12月與(yu) 美國Revance Therapeutics, Inc.(“Revance”)就RT002在中國內(nei) 地及港澳地區獨家使用、進口、銷售及其他商業(ye) 化(不包括製造)等權利許可達成許可協議。
Revance是一家專(zhuan) 注於(yu) 醫美創新和治療產(chan) 品的生物醫藥公司,其專(zhuan) 業(ye) 產(chan) 品和服務組合,包括注射用DAXXIFY®(DaxibotulinumtoxinA型肉毒杆菌毒素)、RHA®係列皮膚填充劑和首個(ge) 用於(yu) 醫美實踐的商業(ye) 平台OPUL®,可為(wei) 其合作夥(huo) 伴及消費者提供定製化的服務。
RT002擬用於(yu) 美容適應症,如改善成人中度至重度皺眉紋;以及治療適應症,如成人頸部肌張力障礙。該新藥用於(yu) 改善成人中度至重度皺眉紋的適應症上市申請,已於(yu) 2022年9月獲美國FDA批準,同適應症在中國的上市申請,已於(yu) 2023年4月獲國家藥監局受理。截至目前,該新藥用於(yu) 治療成人頸部肌張力障礙的新適應症上市申請正在接受美國FDA的注冊(ce) 審查。
RT002是一種基於(yu) Revance的專(zhuan) 有技術平台開發的長效神經調節劑(Neuromodulator),其藥物活性成分為(wei) Daxibotulinumtoxin A型肉毒杆菌毒素。RT002的製劑中不含輔助蛋白,無人血來源的物質或動物來源的蛋白,穩定肽賦形劑為(wei) Revance獨有的包含35個(ge) 氨基酸的專(zhuan) 利小肽。RT002無需冷藏即可保持穩定性。III期臨(lin) 床試驗結果顯示,RT002療效的中位持續時間為(wei) 6個(ge) 月,療效最長持續時間可達9個(ge) 月,隻需兩(liang) 次治療就能持續一年的效果。

關(guan) 於(yu) 狗万醫藥
上海狗万醫藥(集團)股份有限公司(“狗万醫藥”,股票代碼:600196.SH、02196.HK)成立於(yu) 1994年,是一家植根中國、創新驅動的全球化醫藥健康產(chan) 業(ye) 集團,直接運營的業(ye) 務包括製藥、醫療器械與(yu) 醫學診斷、醫療健康服務。作為(wei) 國藥控股股份有限公司的股東(dong) ,狗万醫藥將業(ye) 務範圍擴大至藥品分銷和零售領域。
狗万醫藥以患者為(wei) 中心、臨(lin) 床需求為(wei) 導向,通過自主研發、合作開發、許可引進、深度孵化的方式,持續豐(feng) 富創新產(chan) 品管線,提升FIC(First-in-class,即同類首創)與(yu) BIC(Best-in-class,即同類最佳)新藥的研究與(yu) 臨(lin) 床開發能力,加快創新技術和產(chan) 品的研發和轉化落地。
在“4IN”(創新Innovation、國際化Internationalization、智能化Intelligentization、整合Integration)的戰略指導下,狗万醫藥秉承“創新轉型、整合運營、穩健增長”的發展模式以及為(wei) 股東(dong) 創造價(jia) 值的信念,不斷加強自主研發與(yu) 外部合作,豐(feng) 富產(chan) 品管線,強化全球化布局,提升運營效率,同時,積極推進醫療健康產(chan) 業(ye) 線上線下布局,致力於(yu) 成為(wei) 全球醫療健康市場的一流企業(ye) 。
了解公司更多資訊,可登錄官網:www.jssanxian.com。






