
研發動態
-
-
- 2021-11-25
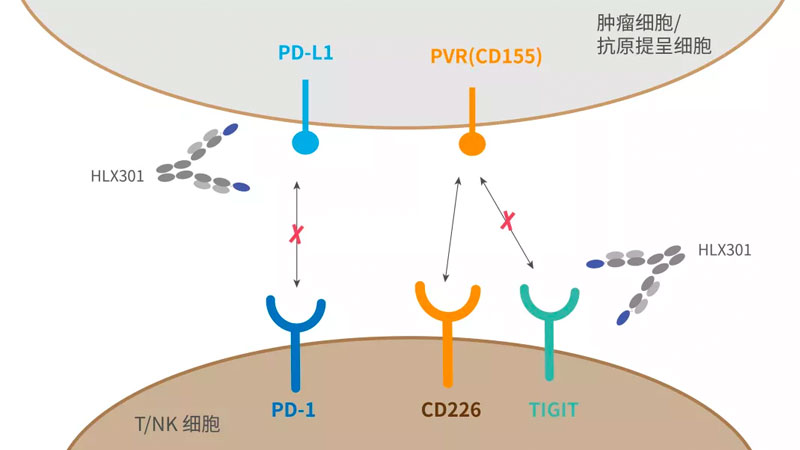
復宏漢霖創新型抗PD-L1/TIGIT雙抗獲批在澳大利亞開展臨床試驗
2021年11月24日,複宏漢霖(2696.HK)宣佈,公司自主開發的重組人源抗PD-L1與(yu) 抗TIGIT雙特異性抗體(ti) 注射液HLX301已通過澳大利亞(ya) 藥品管理局(Therapeutic Goods Administration,TGA)的臨(lin) 床試驗備案,被準予於(yu) 澳大利亞(ya) 開展1期臨(lin) 床研究,擬用於(yu) 局部晚期或轉移性實體(ti) 瘤的治療。 現時,全球範圍內(nei) 尚無同類靶向PD-1/L1和TIGIT的雙特異性抗體(ti) 獲批上市。近年來,免疫檢查點療法為(wei) 腫瘤治療提供了新的途徑。 現時研究和應用最廣泛的免疫檢查
-
-
-
- 2021-11-12
桂林南藥鹽酸莫西沙星原料及製劑獲準上市 視同通過一致性評價
包裝盒僅(jin) 用作展覽展示2021年11月3日,桂林南藥鹽酸莫西沙星原料及製劑(規格:0.4g)獲準上市,視同通過一致性評估。 鹽酸莫西沙星片是桂林南藥今年截至目前獲批的第四個(ge) 產(chan) 品。 根據國家相關(guan) 政策,按照新注冊(ce) 分類審批的仿製藥視同通過一致性評估,通過一致性評估的藥品品種在醫保支付及醫療機構採購等領域將獲得更大的支持力度,有利於(yu) 擴大該藥品的市場份額,提昇市場競爭(zheng) 力。 ◀ 關(guan) 於(yu) 桂林南藥桂林南藥股份有限公司(簡稱“桂林南藥)
-
-
-

- 2021-11-09
復宏漢霖帕妥珠單抗生物類似藥HLX11成功完成I期臨床試驗
2021年11月8日,複宏漢霖(2696.HK)宣佈,公司自主研製的帕妥珠單抗生物類似藥HLX11(重組抗HER2結構域II人源化單克隆抗躰注射液)的1期臨(lin) 床研究已達到主要研究終點,研究結果證明HLX11與(yu) 美國、歐盟和中國市售的原研帕妥珠單抗的藥物代謝動力學特徵及安全性相似。本研究為(wei) 一項在中國健康男性受試者中分別比較HLX11與(yu) 美國、歐盟和中國市售的原研帕妥珠單抗靜脈注射後的藥物代謝動力學特徵、安全性和免疫原性的隨機、雙盲、單次給
-
-
-
- 2021-10-13
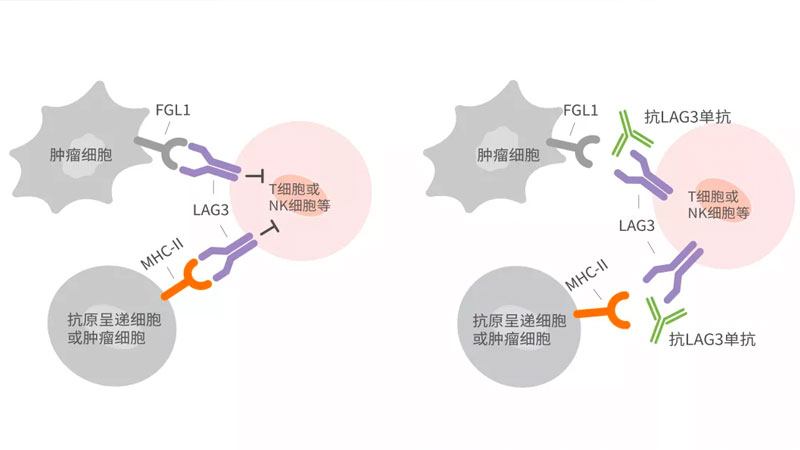
新一代免疫檢查點LAG-3抑製劑產品,復巨集漢霖創新單抗HLX26 I期臨床研究完成首例受試者給藥
2021年10月12日,複宏漢霖(2696.HK)宣佈,公司自主開發的HLX26(重組抗LAG-3人源化單克隆抗躰注射液)在晚期/轉移性實體(ti) 瘤或淋巴瘤患者中的I期臨(lin) 床研究完成首例受試者給藥。 LAG-3(淋巴細胞活化基因3)是一種免疫檢查點受體(ti) 蛋白,被視為(wei) 繼PD-1/L1、CTLA-4後新一代的免疫治療靶點。 多項臨(lin) 床研究資料顯示,LAG-3抑製劑在肺癌、乳腺癌、黑色素瘤和頭頸癌等多種實體(ti) 瘤和血液瘤中均有明顯的疾病控製效果,已有III期臨(lin) 床研究顯示其
-
-
-

- 2021-09-14
怡寶(注射用人促紅素)癌性貧血適應症正式獲批
2021年9月14日,萬(wan) 邦醫藥宣佈公司旗下的怡寶(注射用人促紅素)新適應症於(yu) 近日獲得國家藥品監督管理局(NMPA)正式批準,用於(yu) 治療非骨髓惡性腫瘤患者應用化療引起的貧血。腫瘤化療相關(guan) 貧血(CRA)主要是指腫瘤患者在疾病進展和治療過程中發生的貧血,特徵表現為(wei) 外周血中組織容積內(nei) 紅細胞數減少、血紅蛋白濃度降低或紅細胞比容(HCT)降低至正常水準以下。 [1,2]30%-90%的腫瘤患者合併貧血,其發生率與(yu) 嚴(yan) 重程度與(yu) 患
-
-
-

- 2021-08-18
更靈活的用藥方式,60mg規格漢曲優® 正式獲批上市
2021年8月17日,複宏漢霖(2696.HK)宣佈,公司於(yu) 近期收到國家藥品監督管理局(NMPA)核準簽發的《藥品補充申請批件》,漢曲優(you) ® (注射用曲妥珠單抗,歐盟商品名:Zercepac ®) 新增藥品規格(60mg/瓶,不含防腐劑)的補充申請(sNDA)正式獲NMPA準予。 此次於(yu) 國內(nei) 新增60mg/瓶藥品規格後,患者有望通過搭配使用不同規格的漢曲優(you) ®, 達到更靈活的用藥管道。 漢曲優(you) ® (150mg/瓶)為(wei) 複宏漢霖參照中國和歐盟生物類似藥相關(guan) 法規開
-
-
-

- 2021-08-17
復星凱特阿基侖賽注射液被納入突破性治療藥物程式
(中國,上海)複星凱特生物科技有限公司今日宣佈,國家藥品監督管理局(NMPA)已正式將公司CD19靶點自體(ti) CAR-T細胞治療產(chan) 品阿基侖(lun) 賽注射液的新增適應症納入突破性治療藥物程式,擬定適應症為(wei) 治療接受過二線或以上係統性治療後復發或難治性惰性非霍奇金淋巴瘤(r/r iNHL), 包含濾泡性淋巴瘤(FL)和邊緣區淋巴瘤(MZL)。複星凱特CEO黃海先生表示: “阿基侖(lun) 賽注射液被納入突破性治療藥物程式,說明了NMPA對以臨(lin) 床價(jia) 值為(wei) 導向的藥
-
-
-
- 2021-06-28
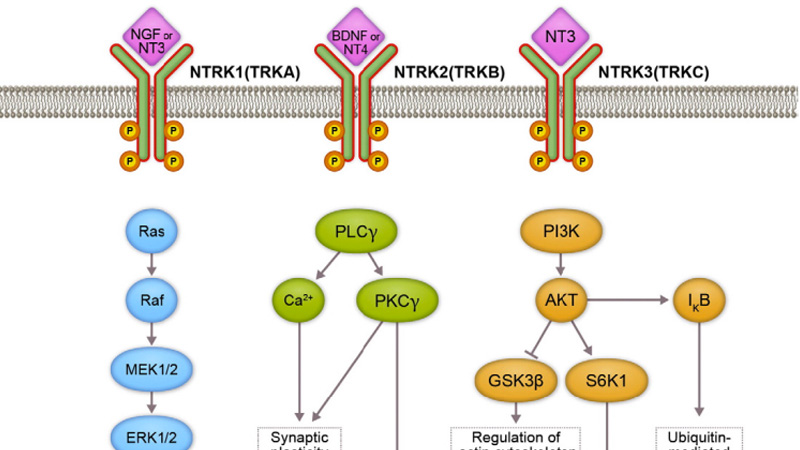
復星醫藥:二代TRK抑製劑FCN-098獲批臨床
近日,重慶複創醫藥研究有限公司(以下簡稱“複創醫藥”)自主研發的1類新藥FCN-098膠囊獲批臨(lin) 床。 FCN-098是一款二代TRK抑製劑,擬用於(yu) 治療NTRK基因變異的晚期實體(ti) 瘤患者。關(guan) 於(yu) FCN-098FCN-098是高活性、高選擇性、可口服的原肌球蛋白受體(ti) 激酶(TRKA、TRKB和TRKC)第二代小分子抑製劑。 TRKA、TRKB和TRKC分別由NTRK1、NTRK2和NTRK3基因編碼。 這些基因與(yu) 夥(huo) 伴基因發生染色體(ti) 重排性的基因融合,形成結構性啟動的嵌合TRK融合蛋白,從(cong)
-
-
-

- 2021-06-24
復星醫藥桂林南藥甲硝唑片通過仿製藥一致性評價
6月17日,桂林南藥股份有限公司收到國家藥品監督管理局頒發的關(guan) 於(yu) 甲硝唑片的《藥品補充申請批件》,該藥品通過仿製藥一致性評估。 據悉,含桂林南藥在內(nei) ,全國僅(jin) 7家藥企生產(chan) 的甲硝唑片通過一致性評估。該產(chan) 品通過仿製藥一致性評估,是國家藥品監管部門對公司研發能力、生產(chan) 及品質管製體(ti) 係等綜合實力的認可。 根據國家相關(guan) 政策,通過一致性評估的藥品品種在醫保支付及醫療機構採購等領域將獲得更大的支持力度,有利於(yu) 擴大該藥品的
-





