
研發動態
-
-

- 2021-06-23
復星凱特首個 CAR-T 產品奕凱達®(阿基侖賽注射液)獲批上市
【中國,上海】複星凱特生物科技有限公司(以下簡稱“複星凱特”)今日宣佈,國家藥品監督管理局已正式批準公司靶向人CD19自體(ti) CAR-T細胞治療產(chan) 品奕凱達 ® (阿基侖(lun) 賽注射液)的新藥上市申請,該藥品為(wei) 中國首個(ge) 獲批準上市的細胞治療類產(chan) 品,用於(yu) 治療既往接受二線或以上係統性治療後復發或難治性大B細胞淋巴瘤(r/r LBCL)成人患者,包括彌漫性大B細胞淋巴瘤(DLBCL)非特指型(NOS)、原發縱隔大B細胞淋巴瘤(PMBCL)、 高級別B細
-
-
-

- 2021-06-11
復星凱特FKC876新增適應症獲批臨床
【中國,上海】複星凱特生物科技有限公司今日宣佈,國家藥品監督管理局(NMPA)已正式批準公司CD19靶點自體(ti) CAR-T細胞治療產(chan) 品阿基侖(lun) 賽注射液(FKC876)的新增適應症注冊(ce) 臨(lin) 床試驗申請(IND)【受理號CXSL2100098】,用於(yu) 治療二線或以上係統性治療後復發或難治性惰性非霍奇金淋巴瘤(r/r iNHL)。 複星凱特CEO黃海先生表示:“2021年3月5日,FDA加速準予了Yescarta(axicabtagene ciloleucel)用於(yu) 治療復發/難治性濾泡性淋巴瘤成人
-
-
-

- 2021-06-02
復星醫藥:氯雷他定片通過仿製藥一致性評價
近日,複星醫藥旗下萬(wan) 邦醫藥成員企業(ye) 江蘇黃河藥業(ye) 股份有限公司收到國家藥品監督管理局核準簽發的氯雷他定片(規格:10mg)的《藥品補充申請批準通知書(shu) 》,該產(chan) 品通過仿製藥質量與(yu) 療效一致性評估。據世界衛生組織數據,全球有20%-30%的普通人被過敏症狀困擾。 在我國,有2.7億(yi) 人受到輕重不同的過敏症困擾,如皮膚紅腫、瘙癢、斑疹及呼吸係統等常見過敏性疾病的常見症狀。抗組胺藥物是臨(lin) 床上廣泛使用的抗過敏藥物,主要用於(yu) 變應性
-
-
-

- 2021-06-01
復星醫藥自主研發小分子創新藥FCN-159片獲美國FDA臨床試驗批準
【中國上海,2021年6月1日】上海複星醫藥(集團)股份有限公司(以下簡稱“複星醫藥”;股票代碼:600196.SH;02196.HK)發佈公告, 控股子公司上海複星醫藥產(chan) 業(ye) 發展有限公司(簡稱“複星醫藥產(chan) 業(ye) ”)近日收到美國FDA(即食品藥品監督管理局)關(guan) 於(yu) 同意其參與(yu) 研製的FCN-159片(以下簡稱“該新藥”)用於(yu) 治療成人和兒(er) 童I型神經纖維瘤病(NF1)進行臨(lin) 床試驗的函。 複星醫藥產(chan) 業(ye) 擬於(yu) 條件具備後於(yu) 美國進行該新藥針對本次獲批適應症的臨(lin)
-
-
-
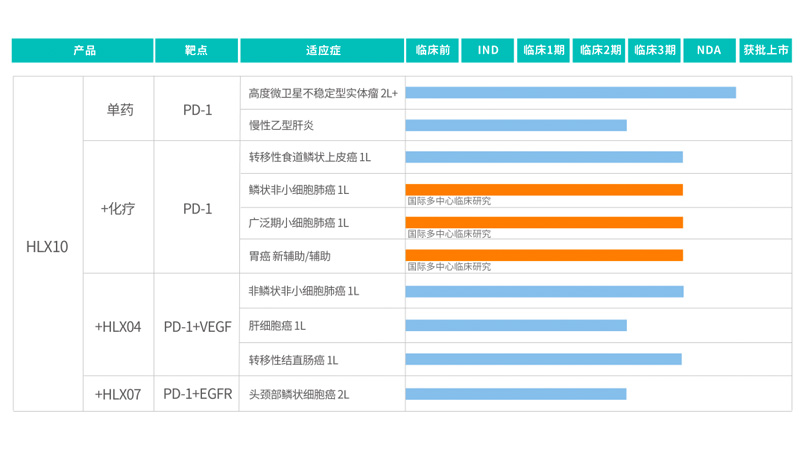
- 2021-04-23
復星醫藥:復宏漢霖創新抗PD-1單抗斯魯利單抗上市註冊申請獲NMPA受理,擬納入優先審評程式
2021年4月22日,複宏漢霖(2696.HK)宣佈,自主研製的創新型PD-1抑製劑斯魯利單抗注射液(HLX10)針對經標準治療失敗的、不可切除或轉移性高度微衛星不穩定型(Microsatellite Instability-High,MSI-H)實體(ti) 瘤適應症的上市註冊(ce) 申請(NDA)正式獲得國家藥品監督管理局(NMPA)受理,並擬納入優(you) 先審評程式, 有望成為(wei) 國內(nei) 首個(ge) 治療MSI-H實體(ti) 瘤的抗PD-1單抗。 該適應症依據特定的MSI-H腫瘤標誌物進行篩查,不以癌種進行區分,覆蓋患
-
-
-

- 2021-04-21
第三個境外臨床許可,復宏漢霖貝伐珠單抗HLX04-O眼科適應症於歐盟獲批臨床
2021年4月20日,複宏漢霖(2696.HK)宣佈公司與(yu) 億(yi) 勝生物合作開發的重組抗VEGF人源化單克隆抗躰眼用注射液HLX04-O的臨(lin) 床試驗申請在歐盟國家拉脫維亞(ya) 獲批,擬用於(yu) 濕性年齡相關(guan) 性黃斑變性(wAMD)的治療。 這是繼澳大利亞(ya) 和美國之後,HLX04-O獲得的第三個(ge) 境外臨(lin) 床試驗許可,也是HLX04-O首次獲批於(yu) 歐盟國家開展臨(lin) 床試驗。 與(yu) 此同時,公司已陸續向匈牙利、西班牙、捷克共和國等其他歐盟國家遞交了HLX04-O的臨(lin) 床試驗申請,預計將於(yu) 近期
-
-
-

- 2021-04-16
復宏漢霖免疫檢查點抑製劑又添新成員,創新型抗LAG-3單抗IND申請獲NMPA批準
2021年4月15日,複宏漢霖(2696.HK)宣佈,公司自主開發的HLX26(重組抗LAG-3人源化單克隆抗躰注射液)的臨(lin) 床試驗申請獲得國家藥品監督管理局(NMPA)準予,有望用於(yu) 實體(ti) 瘤及淋巴瘤的治療。淋巴細胞活化基因3(Lymphocyte-activation gene 3,LAG-3)是一種免疫檢查點受體(ti) 蛋白,被視為(wei) 繼PD-1/L1、CTLA-4後新一代的免疫治療靶點,全球現時暫無該靶點產(chan) 品上市。 多項臨(lin) 床研究資料顯示,LAG-3抑製劑在肺癌、乳腺癌、黑色素瘤和頭頸
-
-
-
- 2021-04-12
漢霖頭條 | 漢達遠®葡萄膜炎新適應症補充申請正式獲批
2021年4月12日,複宏漢霖(香港聯交所程式碼:2696)宣佈公司自主開發的漢達遠 ® (HLX03,阿達木單抗注射液)用於(yu) 治療成人非感染性中間、後和全葡萄膜炎的補充申請(sNDA)於(yu) 近日正式獲得國家藥品監督管理局(NMPA)準予。 這是繼類風濕關(guan) 節炎、強直性脊柱炎、銀屑病之後,漢達遠 ® 在國內(nei) 獲批的第四個(ge) 適應症。漢達遠 ® 是複宏漢霖按照中國生物類似藥指導原則自主開發的單抗生物類似藥,也是公司首款治療自身免疫疾病的產(chan) 品。 20
-
-
-

- 2021-03-22
美國FDA批準臨床,復宏漢霖貝伐珠單抗眼科適應症再獲境外臨床試驗許可
2021年3月19日,複宏漢霖(2696.HK)宣佈公司與(yu) 億(yi) 勝生物合作開發的重組抗VEGF人源化單克隆抗躰眼用注射液HLX04-O的臨(lin) 床試驗申請獲美國食品藥品管理局(FDA)準予,擬用於(yu) 濕性年齡相關(guan) 性黃斑變性(wAMD)的治療。這是繼順利通過澳大利亞(ya) 藥品管理局(Therapeutic Goods Administration,TGA)的臨(lin) 床試驗備案獲批準於(yu) 澳大利亞(ya) 開展3期臨(lin) 床試驗後,HLX04-O獲得的又一境外臨(lin) 床試驗許可。 該項目將於(yu) 近期啟動一項分兩(liang) 部分開展的3期、全球
-





